Um die Chemie des Feuers besser verstehen zu lernen, traf sich am Montag, den 12.02.2023 die Abschnitts-Schadstoffgruppe in Purkersdorf. Die Feuerwehren Gablitz, Irenental, Mauerbach, Pressbaum, Purkersdorf, Rekawinkel, Steinbach, Tullnerbach und Wolfsgraben waren mit 41 Kamerad:innen vertreten.
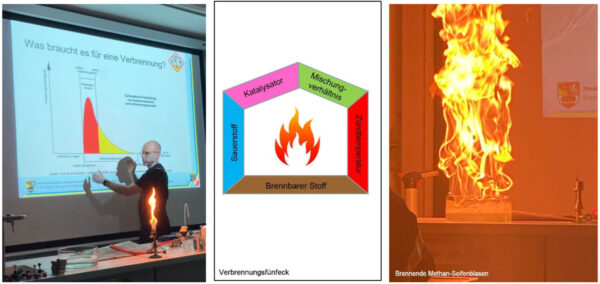
Verbrennungsreaktionen zählen zu den komplexesten Reaktionen, die die Chemie kennt. Allein bei der Verbrennung von Methan (CH4), dem einfachsten und kleinsten Kohlenwasserstoff, sind mehr als 150 relevante Reaktionsschritte bekannt. Aber so kompliziert brauchen wir es gar nicht. Wenn unsere Feuerwehrleute das Verbrennungsfünfeck, eine Erweiterung des allgemein bekannten, aber zu einfachen Verbrennungsdreiecks, verinnerlichen, werden viele Methoden der Brandbekämpfung viel besser verständlich.
Was sind die Grundvoraussetzungen einer jeden Verbrennung? Es braucht einen Brennstoff, Sauerstoff, das richtige Mischungsverhältnis, einen Katalysator sowie eine ausreichende Aktivierungsenergie. Als Brennstoff kommen viele Gegenstände des Alltags in Frage. Die meisten denken gleich an Benzin oder Diesel, Holz, Papier, Wachs oder den trockenen Christbaum. Aber auch Metalle wie Magnesium oder Aluminium können unter den passenden Bedingungen zum Brennstoff werden, der weder mit Wasser noch mit CO2 gelöscht werden kann. Auch die Quellen für Sauerstoff, der für eine Verbrennung essenziell ist, können vielfaltig sein. Für die meisten Brennstoffe reichen die 20,9 Vol% Sauerstoff in der Atemluft völlig aus. Jedoch kommt Sauerstoff auch in chemisch gebundener Form in vielen Verbindungen vor. Wir erinnern uns vermutlich alle an den August 2020, als im Hafen von Beirut 2750 Tonnen unsachgemäß gelagerten Ammoniumnitrats (NH4NO3) bei einem Brand zu einer Tragödie führten. Die Explosion zerstörte weite Teile des Hafens und richtete Schäden in großen Teilen der Stadt an. Viele Raketentreibstoffe und Sprengstoffe bedienen sich chemisch gebundenen Sauerstoffs in Form von Nitraten, Chloraten oder Perchloraten. Aber selbst Eisen(III)-oxid, welches wir eher als Bestandteil von Rost kennen, kann in der Thermitreaktion den Sauerstoff zur Verbrennung von Aluminiumpulver liefern und in reduzierter Form als flüssiges Eisen Schienen verschweißen oder Feststoffraketen antreiben. Für manche Verbrennungen reicht eine Aktivierungsenergie in Form eines Funkens, z.B. die Verbrennung von Wasserstoff oder Methangas. Bei anderen Verbrennungsreaktionen wird schon mehr Energie benötigt. So muss Diesel eine Temperatur von über 56 °C aufweisen, damit er sich entzünden lässt, während das bei Benzin schon bei -20 °C gelingt. Für die zuvor erwähnte Thermitreaktion sind Zündtemperaturen von über 2000 °C notwendig.
Wenn man die Komponenten des Verbrennungsfünfecks berücksichtigt, werden die typischen Strategien bei der Brandbekämpfung viel besser verständlich. Beim Löschen mit Wasser wird dem Feuer in erster Linie Energie entzogen. Der Wasserdampf verdrängt aber auch einen Teil des für die Verbrennung notwendigen Sauerstoffs. Beim Löschen mit Schaum steht der Sauerstoff-verdrängende Effekt im Vordergrund. Schaum ist besonders bei flüssigen Brennstoffen, die leichter sind als Wasser (Öl, Benzin, Diesel), das Löschmittel der Wahl. Würde man versuchen, brennenden Treibstoff mit Wasser zu löschen, würde der Treibstoff aufgrund seiner geringeren Dichte auf dem Wasser brennend davonschwimmen und die Brandfläche würde sich signifikant vergrößern. Das Löschen von brennendem Fett mit Wasser würde sogar zu einer Explosion führen, da das Wasser unter das weit über 100 °C heiße Fett sinkt, schlagartig verdampft und dabei große Mengen feiner Fetttröpfchen mitreißt, die sich dann entzünden. Um Fettbrände sicher löschen zu können, werden Löschdecken, Fettbrandlöscher oder einfach ein Topfdeckel benutzt.
Bei Metallbränden darf weder Wasser noch Schaum verwendet werden, da die Temperaturen so hoch sind, dass Wasser in seine Bestandteile Wasserstoff und Sauerstoff gespalten wird, was zu einer sofortigen Explosion führt. Einen Metallbrand könnte man mit trockenem Sand erfolgreich bekämpfen, indem der geschmolzene Sand die Luftzufuhr behindert und so den Brand erstickt.
Viele der erwähnten Beispiele konnten anhand von Experimenten im Chemiesaal oder im Anschluss an den Vortrag vor der Feuerwache praktisch demonstriert werden.
Danke den Teilnehmer:innen für ihr aktives Zuhören, den Purkersdorfer Kamerad:innen für die Unterstützung bei den Vorbereitungen der Outdoor-Experimente sowie dem Chemielehrer Herrn Mag. Erwin Klein für seine Gastfreundschaft und seine großartige Unterstützung mit Fachwissen und Experimentiererfahrung. Für die Möglichkeit, den Chemiesaal des BG|BRG Purkersdorf nutzen zu dürfen, bedanke ich mich herzlich bei Direktorin Frau HRin Mag.a Irene Ille.